A HUN-REN Természettudományi Kutatóközpont (HUN-REN TTK) több kutatócsoportja és a Bécsi Orvostudományi Egyetem Rákkutató Intézetének munkatársai közös projekt keretében új támadáspontot azonosítottak a kemoterápiát túlélő tumorsejtekben. Az eredmenyek klinikai alkalmazásával meghosszabbíthatóvá válhat a rákos betegek túlélése. A felfedezésről szóló tanulmány a gyógyszerrezisztencia-kutatás csúcsfolyóiratában, a Drug Resistance Updatesben jelent meg.
Fókuszban a rezisztencia
A rákos daganatok sikeres kezelése továbbra is komoly kihívást jelent világszerte. A daganatos betegek egy része rendkívül jól reagál a kezdeti terápiákra: a tumor mérete csökken, akár teljesen eltűnhet, ami együtt jár a közérzet és az általános állapot javulásával. Sajnos azonban előfordul, hogy a daganat újra megjelenik, és idővel ellenállóvá válik a további kezelésekkel szemben. Az elmúlt évtizedekben a kutatás fókusza a terápiarezisztencia mechanizmusainak megértésére, illetve a rezisztens daganatok elpusztítására koncentrált, azt feltételezve, hogy a rezisztenciát fenntartó mechanizmusok kiiktatása a betegek hosszabb túlélését, akár teljes gyógyulását is jelentheti.
A HUN-REN TTK munkatársai egy új megközelítéssel a már ellenálló ráksejtek helyett a terápiarezisztencia kialakulásának korai lépéseit vizsgálták. Ennek során arra a látszólag egyszerű kérdésre keresték a választ, hogy ha a daganatok jelentős része jól reagál a kezelésre, mégis mivel magyarázható a tumorok kiújulása. Nyilvánvaló, hogy a terápiát néhány sejt túléli, ezek aztán hosszú hónapokig vagy akár évekig is szunnyadó állapotban maradhatnak.
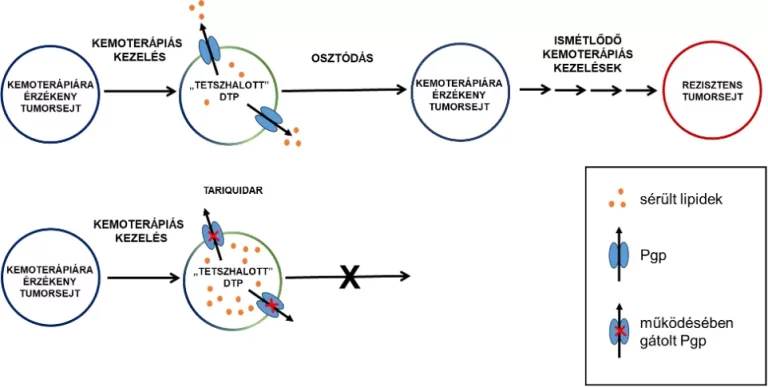
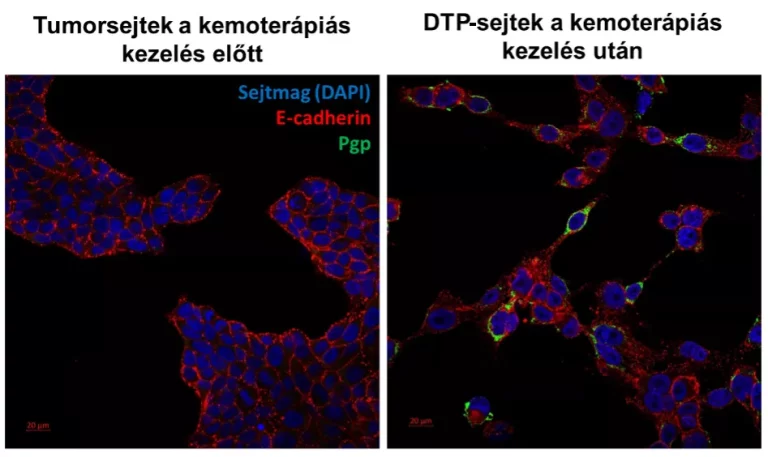
E jelenség tanulmányozásában a kihívást a kezelést túlélő sejtek ritka mivolta jelenti, ezért a HUN-REN TTK Gyógyszerrezisztencia Kutatócsoport, a Metabolikus Gyógyszer-kölcsönhatások Kutatócsoport és a Szerkezetkutató Központ, valamint a Bécsi Orvostudományi Egyetem Rákkutató Intézetének munkatársai együttműködésben egy új modellrendszert dolgoztak ki. Ebben a nagy dózisú kemoterápiát követően az emlőtumorsejtek zöme elpusztul, néhány sejt azonban – ahogy a betegekben is – túlél. A vizsgálatok során kiderült, hogy a kemoterápiás kezelést túlélő, úgynevezett drogtoleráns perziszter (DTP) sejtek annak ellenére maradnak életben, hogy súlyos DNS-károsodást szenvednek. A túlélő sejtek szokatlan, bizarr morfológiát mutattak, egyáltalán nem osztódtak, és úgy tűnt, hogy előbb-utóbb valamennyien elpusztulnak. A kutatók meglepetésére azonban a „tetszhalott” sejtek hetekkel később felébredtek, és újra osztódni kezdtek.
A túlélő tumorsejtek Achilles-ina
A DTP-sejtekből újraépülő daganatok nem váltak ellenállóvá, ami arra utalt, hogy a daganat túlélése nem az eredetileg is rezisztens sejtek kiválogatódásával, hanem átmenetileg megjelenő okokkal magyarázható. A túlélő sejtek alaposabb vizsgálatával kiderült, hogy egy részük kifejezi a P-glikoprotein (Pgp) nevű fehérjét, melynek gátlásával a sejtek felébredése teljes mértékben megelőzhetőnek bizonyult. A Pgp megjelenése rezisztens sejtekben ismert, feladata ugyanis az, hogy a ráksejtek membránjában ülve felismerje és kipumpálja a kemoterápia gyógyszermolekuláit a sejtekből. A szunnyadó sejteknek azonban nem lehetett szükségük erre a védelemre, mert környezetükben már nem volt jelen kemoterápiás hatóanyag.
Ez a felismerés arra sarkallta a kutatókat, hogy megértsék a Pgpnek a DTP-sejtek védelmezésében betöltött szerepét, és ha lehetséges, célzott terápiát dolgozzanak ki. A kutatócsoport rájött, hogy a kemoterápia közvetlen, toxikus hatása mellett számolni kell egy másodlagos, elhúzódó következménnyel is. A kemoterápia után megmaradó DTP-sejtek túlélésének záloga, hogy megszabaduljanak a sejtmérgezés hosszú távú következményeitől.
Egy ilyen fenyegetés a kemoterápia következményeként megjelenő oxidált lipidek feldúsulása, ami további lipideket károsítva láncreakciót indíthat el, ami óhatatlanul sejthalálhoz vezet. A sejtekben több fehérje vigyáz az oxidált lipidek ártalmatlanítására, azonban különleges esetekben, mint például a kemoterápia esetén, a sérülés mértéke meghaladja a rendszer kapacitásait, és szükség van másodlagos mechanizmusokra, amelyek csökkenthetik a sejtre nehezedő nyomást. Ekkor avatkozik közbe a Pgp, amely a sejten kívülre juttatja a sérült lipideket, esélyt adva a DTP-sejtek túlélésére.
Egy rég ismert gyógyszer újfajta felhasználása
A laboratóriumi megfigyelésre alapozva a kutatók a Pgp-gátló tariquidar hatóanyagot nem a már ellenálló tumorsejtek ellen kívánták bevetni, hanem a kezdeti kezelést túlélő perziszter sejteket célozták meg. Az új terápiás protokollt olyan egéremlőtumorokon tesztelték, amelyek genetikai módosítások következtében jól modellezik az emberekben előforduló tripla-negatív öröklött mellrákot.
A laboratóriumban kidolgozott modell szerint a gátlószert a kemoterápia után adagolták, egyszersmind megelőzve a korábbi protokollok során tapasztalt mellékhatásokat, melyek során a tariquidar fokozta a vele egyidejűleg adagolt kemoterápiás szerek egészséges sejtekre gyakorolt toxicitását. Az eredmények egyértelműen igazolták a laboratóriumi modelleket: azok az egerek, amelyekben a korai túlélő DTP-sejteket a kemoterápiás kezelést követően tariquidarral céloztak meg, szignifikánsan tovább maradtak tumormentesek, és tovább éltek társaiknál.
Hangsúlyozandó, hogy a kísérletekben egy olyan hatóanyag új alkalmazására tettek javaslatot a kutatók, amely korábban már megfelelt a klinikai alkalmazást szabályozó szigorú feltételeknek. Mivel ebben az esetben nincs szükség az olykor évekig tartó preklinikai vizsgálatokra, a kutatók bíznak abban, hogy a megfelelő partnereket bevonva nemsokára elkezdődhet ötletük klinikai tesztelése a rákbetegségek hatékonyabb gyógyításának érdekében.
Publikáció:
Kornélia Szebényi, András Füredi, Eszter Bajtai, Sai Nagender Sama, Ágnes Csiszár, Balázs Gombos, Pál Szabó, Michael Grusch, Gergely Szakács: Effective targeting of breast cancer by the inhibition of ABCB1-mediated removal of toxic lipid peroxidation byproducts from drug tolerant présiére cells, Drug Resistance Updates, https://doi.org/10.1016/j.drup.2023.101007