A Szint-Plusz Tématerületi Kiválósági Program keretében kimagasló aktivitású, kis dózisban alkalmazható új magyar rákellenes gyógyszermolekula-jelöltet fejlesztettek ki az ELTE Szerves Kémiai Tanszék munkatársai.
A tumoros megbetegedések világszerte a vezető halálozási okok között szerepelnek. Az 1990-es évektől kezdve ugrásszerűen megemelkedett a rákbetegek aránya, 2022-ben a rákos megbetegedések miatt bekövetkező halálesetek összesített száma az EU tagállamaiban és az Egyesült Királyságban megközelítette a másfél milliót. A rákos elváltozások kezelése komoly kihívást jelent. A hagyományos kemoterápiás kezelések során gyógyszerként olyan hatóanyagokat alkalmaznak, amelyek elpusztítják ugyan a tumoros sejtek többségét, de az egészséges sejteket is jelentős mértékben károsítják, miközben számos mellékhatást okoznak. Súlyos problémát jelent az áttétek megjelenésével járó daganatok újbóli kifejlődése és a kemoterápiás szerekkel szemben gyakran kialakuló rezisztencia is.
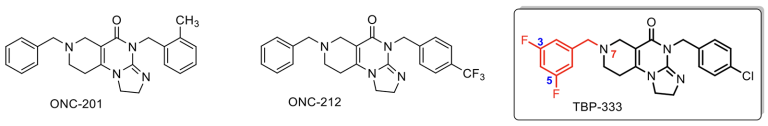
A nehézségek leküzdésében az utóbbi években kiemelkedő szerep jutott az ún. célzott onkológiai terápiás eljárásoknak, amelyek során a felhasznált szer a sejtciklus szabályozásában hibásan működő rákos sejtek kontrollálatlan osztódását molekuláris szinten gátolva leállítja a daganatsejt növekedését. E kezelések meghatározott sejten belüli molekuráris célpontokra – például fehérjékre – irányulnak. Az elmúlt években törzskönyvezett, az elsőgenerációs kemoterápiás szereknél már jóval előnyösebb tulajdonságokkal rendelkező gyógyszermolekulák közé tartoznak a ClpP fehérjét célba vevő, az Egyesült Államokban kifejlesztett kismolekulás potenciális rákellenes imipridononok, amelyek legismertebb képviselői az ONC-201 és ONC-212 (1. ábra).
Az ELTE Természettudományi Karán a Szint-Plusz Tématerületi Kiválósági Program jelentős mértékű finanszírozásával jó ideje folynak új rákellenes hatóanyagok kifejlesztésére irányuló kutatások. Az innovációs törekvések eredményeként az ELTE Szerves Kémiai Tanszék munkatársai eddig több mint 140 új, változatos helyettesítő mintázattal ellátott imipridon vázas vegyületet állítottak elő, amelyek közül a TBP-333 kódnévvel ellátott, két fluor- és egy klóratommal speciális módon helyettesített származékot azonosították minden eddiginél hatékonyabb potenciális rákellenes hatóanyag-jelöltként (1. ábra). Az új magyar szer hatása az összehasonlító tesztek szerint jelentős mértékben meghaladja az amerikai fejlesztők (hasnyálmirigy karcinómában és leukémiában szenvedő betegek bevonásával hamarosan humán klinikai tesztekre kerülő) legígéretesebb hatóanyag-jelöltjeként tekintett ONC-212-ét.
Az innováció nemzetközi szinten mért kimagasló jelentőségét igazolja, hogy a kemoterápiás kezelésekkel szemben nagymértékű rezisztenciát mutató PANC-1 hasnyálmirigy karcinóma sejtekkel szemben a TBP-333 vegyület a szervezetet toxicitás szempontjából jóval kevésbé megterhelő módon, így a káros mellékhatásokat várhatóan háttérbe szorítva, már több nagyságrenddel kisebb dózisban is fejt ki tumorellenes hatást, mint az ONC-212, lévén annál mintegy 4000-szer hatékonyabb. Ez a mérési adatok szerint azt jelenti, hogy a TBP-333 vegyület a PANC-1 hasnyálmirigy karcinóma sejtek 50 %-át mintegy 4000-szer alacsonyabb dózisban képes elpusztítani, mint az ONC-212. A hatóanyag-jelölt rendkívüli hatását számos más, humán rákos sejtvonalon végzett vizsgálat is megerősítette, és már hormonfüggetlen agresszív emlőrák-modelleken kivitelezett állatkísérletek is egyértelműen bizonyítják.
A Csámpai Antal vezette ELTE-s kutatói kör arra jött rá évtizedes, kitartó kísérletezéssel, hogy a TBP-333 molekulán jelzett módon (1. ábra) az imipridonváz 7-es pozíciójába beépített 3,5-difluórbenzil csoport elengedhetetlen a rákellenes hatás drasztikus növelésének szempontjából. Ez az általuk felismert szerkezet–hatás összefüggés képezi “know-how”-ként a szabadalmi beadványuk alapját.
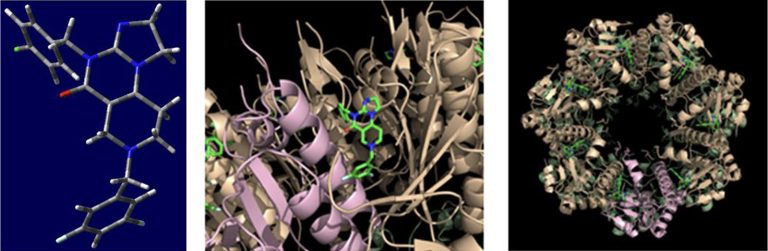
A TBP-333 vegyület nemzetközi színtéren való rendkívüli versenyképességét egyre-másra erősítik meg a tudományos eredmények és ellenőrző vizsgálatok. Az amerikai versenytársakkal is szoros kutatási és innovációs kapcsolatban álló, a szabadalmi anyag közzétételét követően Csámpai Antallal és csoportjával nemzetközi együttműködést kezdeményező Walid Houry professzor torontói kutatócsoportja röntgendiffrakciós módszerrel igazolta, hogy a TBP-333 vegyület 3,5-difluórbenzil csoportja kivételes komplementaritással kötődik a sejt energiaellátását biztosító mitokondriumában lokalizált ClpP fehérje ún. “H-régiójának” hidrofób zsebéhez (2 ábra). Ez a kötődés olyan térszerkezeti változásokat idéz elő, mely „kitágítja” a heptameren belüli csatornát, amin belül ezután lebontásra kerülnek a sejt energiaellátó rendszerét működtető fehérjék, és ez a folyamat végül a rákos sejt pusztulásához vezet.
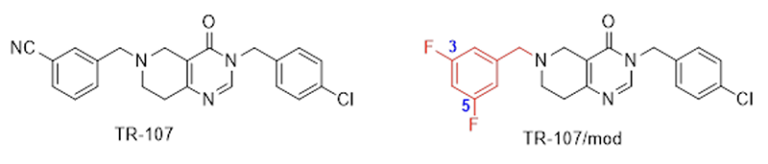
Bebizonyosodott az is, hogy a TBP-333 hatása az amerikai versenytársak által kifejlesztett harmadik generációs ClpP aktivátorok leghatékonyabb képviselőjének, a TR-107 jelű vegyületnek (3. ábra) bizonyos magas halálozási rátával jellemezhető tumorok sejtjein, többek között a hormonfüggetlen MDA-MB-231 agresszív emlőrák sejteken mért aktivitását is messze felülmúlja. Ráadásul a 3-cianobenzil csoportot tartalmazó TR-107 vegyületnek az ELTE kutatói által előállított, 3,5-difluórbenzil csoporttal módosított változata (3. ábra) az említett sejtekkel szemben számottevően hatékonyabbnak mutatkozott, mint a TR-107-vegyület, de nem érte el a TBP-333 vegyület hatását.
Mindezek alapján messzemenően indokolt és kimagasló sikert vetít előre a TBP-333 hatóanyagjelölt fejlesztése klinikai terápiás alkalmazás céljából. Ehhez elsősorban kiterjedt biológiai kutatásokra (sejtes, funkcionális és toxicitási vizsgálatok), valamint további állatkísérletekre van szükség, a vizsgálatokhoz nélkülözhetetlenek a komplex összetételű kémiai és biológiai minták azonosítására, valamint szerkezetvizsgálatára specializálódott módszerek, mindenekelőtt a mágneses magrezonancia technikák alkalmazása is.
Forrás: Eötvös Loránd Tudományegyetem, továbbította a Helló Sajtó! Üzleti Sajtószolgálat.